Resumo Teórico
Ácidos de Arrhenius (Aula 02)
Nomenclatura de Ácidos Inorgânicos
A nomenclatura dos ácidos inorgânicos é essencial para a comunicação precisa e clara na química. Eles são divididos em duas categorias principais: hidráxidos (ácidos binários) e oxiácidos.
Hidráxidos (Ácidos Binários)
Os hidráxidos são compostos formados por hidrogênio e um elemento não metálico. A nomenclatura desses ácidos é simples e segue a estrutura:
- Fórmula Geral: HX, onde X é o não metal.
- Nome: “ácido + radical do elemento + ídrico”.
Exemplos:
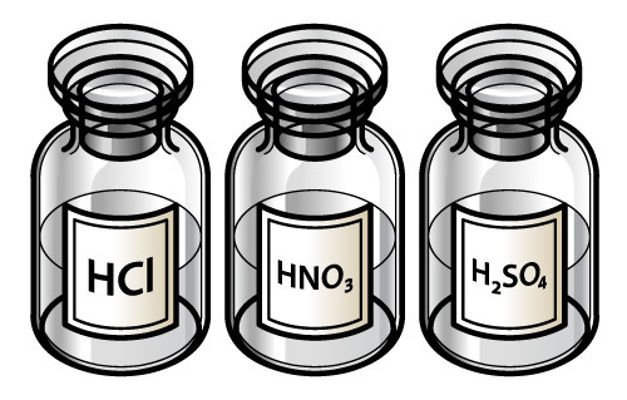
- HCl → ácido clorídrico (cloreto de hidrogênio).
- HF → ácido fluorídrico (fluoreto de hidrogênio).
- HBr → ácido bromídrico (brometo de hidrogênio).
- HI → ácido iodídrico (iodeto de hidrogênio).
- HCN → ácido cianídrico (cianeto de hidrogênio).
- H₂S → ácido sulfídrico (sulfeto de hidrogênio).
Oxiácidos
Os oxiácidos contêm hidrogênio, oxigênio e outro elemento (geralmente um não metal). A nomenclatura dos oxiácidos depende do número de oxigênios e do estado de oxidação do elemento central.
Regras Gerais:
- Maior NOX (estado de oxidação): “ácido + radical do elemento + ico”.
- Menor NOX: “ácido + radical do elemento + oso”.
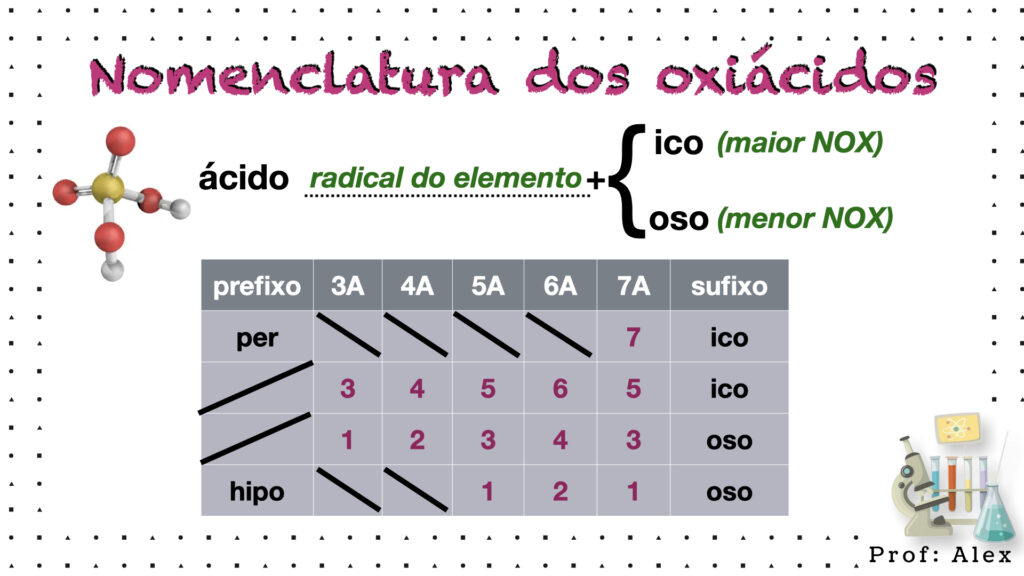
Exemplos:
- HClO₄ → ácido perclórico (estado de oxidação +7).
- HClO₃ → ácido clórico (estado de oxidação +5).
- HClO₂ → ácido cloroso (estado de oxidação +3).
- HClO → ácido hipocloroso (estado de oxidação +1).
- H₂SO₄ → ácido sulfúrico.(estado de oxidação +6)
- H₂SO₃ → ácido sulfuroso.(estado de oxidação +4)
- HNO₃ → ácido nítrico.(estado de oxidação +5)
- HNO₂ → ácido nitroso.(estado de oxidação +3)
- H₃PO₄ → ácido fosfórico.(estado de oxidação +5)
- H₃PO₃ → ácido fosforoso.(estado de oxidação +3)
- H₃PO2 → ácido fosforoso.(estado de oxidação +1)
Formulação dos Hidráxidos
A formulação dos hidráxidos é baseada na combinação de hidrogênio com o não metal correspondente, seguindo a regra de neutralização de cargas.
Exemplos:
- HF → H⁺¹ + F⁻¹.
- H₂S → 2 H⁺¹ + S⁻².
Formulação dos Oxiácidos
A formulação dos oxiácidos envolve a combinação de oxigênio com o elemento central e hidrogênios para neutralizar a carga.
Exemplos:
- H₂SO₄ → SO₃ + H₂O → H₂SO₄.
- H₃PO₄ → P₂O₅ + 3 H₂O → 2 H₃PO₄.
Conclusão
Compreender e aplicar corretamente a nomenclatura dos ácidos inorgânicos é fundamental para a comunicação científica e o estudo das reações químicas. Essas regras permitem a identificação precisa dos compostos e facilitam o aprendizado e a prática da química.
Para baixar o pdf da aula clique no link abaixo: