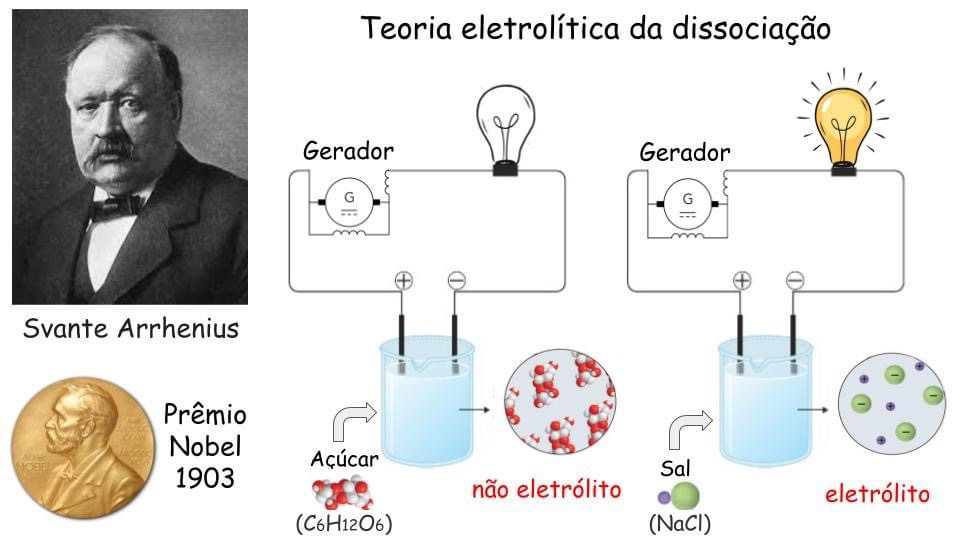
Em 1884, o físico-químico Svante Arrhenius apresentou a sua tese de doutorado sobre a condutividade elétrica de soluções diluídas. É fácil repetirmos alguns de seus experimentos ao dissolvermos açúcar ou sal na água. Podemos constatar que a solução com açúcar não conduz eletricidade, ao passo que a solução salina permite a passagem de corrente elétrica.
O açúcar em contato com a água se divide em porções muito pequenas e com propriedades similares às dos grãos maiores. Arrhenius propôs que quando um sal sólido é dissolvido em água, ele se divide em partículas menores com cargas elétricas. Dessa forma, o sal de cozinha ou cloreto de sódio (NaCl), dissolvido na água, produz Na+ (sódio sem um elétron) e Cl- (cloro com um elétron extra). Esses átomos eletricamente carregados (íons) é que permitem que a solução conduza eletricidade.
Até então imaginava-se que a produção de íons ocorria apenas com a aplicação de energia elétrica, mas Arrhenius sugeriu que os íons podem estar presentes em uma solução. Essa é a Teoria Eletrolítica da Dissociação. Deve-se ressaltar que essa ideia do cientista surgiu 13 anos antes da descoberta do elétron (ver – encurtador.com.br/hsvPV ), a partícula subatômica responsável pela criação de partículas com carga positiva e negativa (chamadas íons). A teoria inovadora levantada por Arrhenius não foi bem recebida e a sua tese foi aprovada com razoável desprezo. Quase duas décadas depois, o Prêmio Nobel de Química de 1903 foi concedido a Arrhenius “em reconhecimento aos serviços extraordinários que prestou ao avanço da química por sua Teoria Eletrolítica da Dissociação”.
REFERÊNCIAS
https://www.nobelprize.org/prizes/chemistry/1903/arrhenius/facts/
