Modelo de Sommerfeld e Modelo Atual
Modelo de Sommerfeld
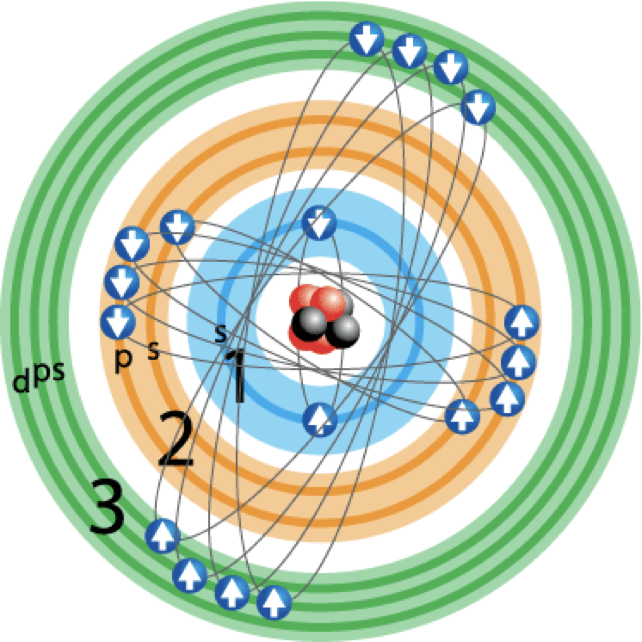

Desenvolvido por Arnold Sommerfeld, uma extensão do modelo atômico de Bohr, o modelo de Sommerfeld introduziu órbitas elípticas para explicar o movimento dos elétrons em torno do núcleo, além das circulares propostas por Bohr. Sommerfeld incorporou a teoria da relatividade especial de Einstein para explicar mais precisamente os espectros de emissão do átomo de hidrogênio. O modelo também introduziu o conceito de quantização do momento angular, que permitiu a explicação das finas estruturas espectrais observadas experimentalmente, algo que o modelo de Bohr não conseguia fazer.
Modelo Atômico Atual (Mecânica Quântica)

O modelo atômico atual é baseado nos princípios da mecânica quântica e substitui a ideia de órbitas definidas por regiões de probabilidade chamadas orbitais atômicos. Diferentemente dos modelos de Bohr e Sommerfeld, onde os elétrons eram tratados como partículas em órbitas precisas, o modelo quântico trata os elétrons como entidades que exibem propriedades tanto de ondas quanto de partículas (dualidade onda-partícula).
Dualidade Onda-Partícula do Elétron

Esta dualidade foi primeiramente proposta por Louis de Broglie, que sugeriu que todas as partículas podem ter características de ondas. A dualidade onda-partícula do elétron significa que ele pode ser descrito tanto como uma partícula quanto como uma onda. Experimentos como a difração de elétrons confirmam essa natureza dual, onde os elétrons podem criar padrões de interferência que são característicos das ondas.
Princípio da Incerteza de Heisenberg
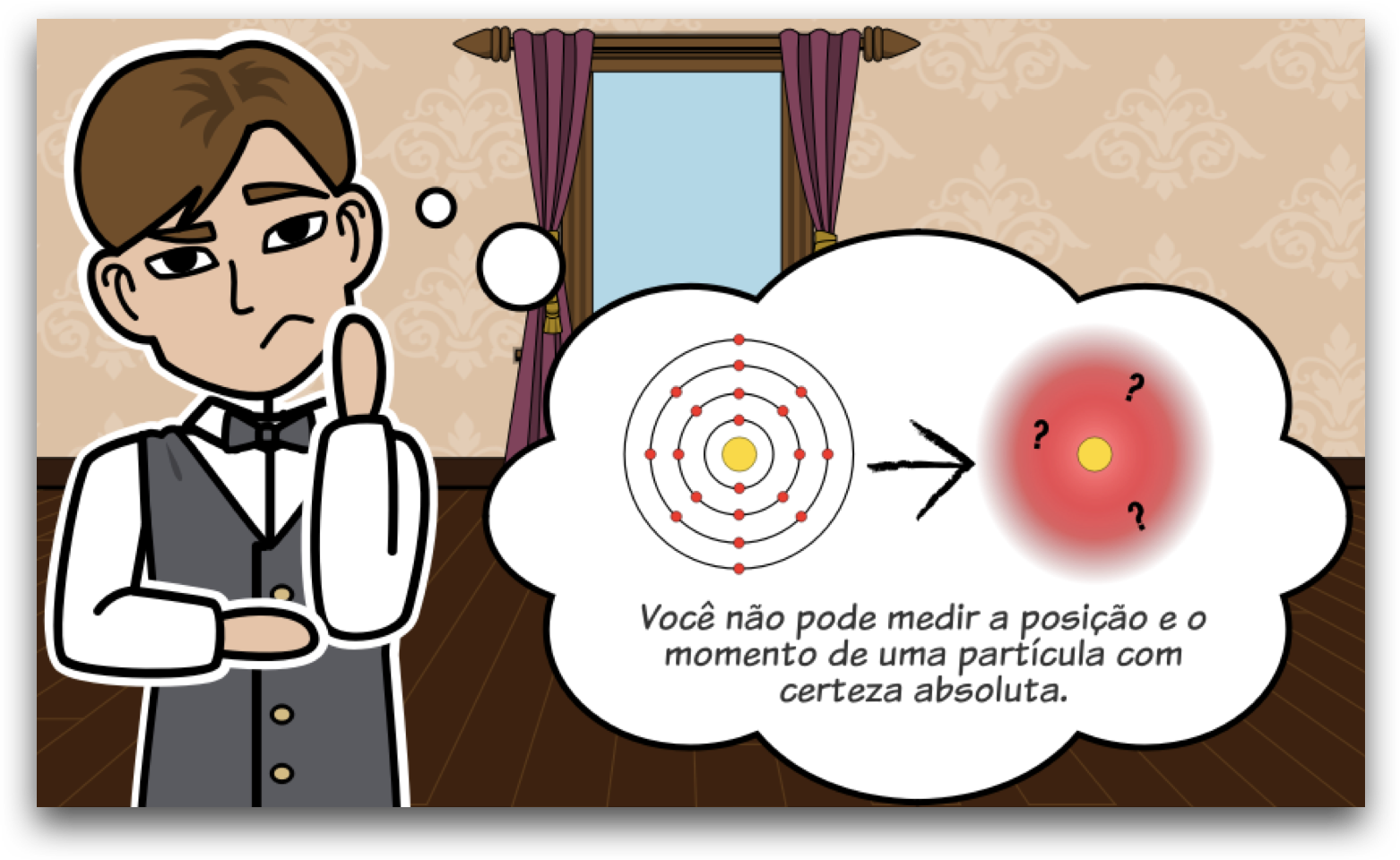
O princípio da incerteza, formulado por Werner Heisenberg, é um conceito fundamental da mecânica quântica que afirma que é impossível medir simultaneamente e com precisão absoluta certos pares de variáveis, como a posição e o momento (velocidade e massa) de uma partícula. No contexto do elétron, isso significa que não podemos determinar exatamente onde um elétron está e como ele está se movendo ao mesmo tempo. Este princípio tem implicações profundas para a descrição dos elétrons em átomos, levando à ideia de orbitais atômicos.
Definição de Orbital

Um orbital atômico é uma função matemática que descreve a onda associada a um elétron em um átomo. Esta função determina a região no espaço ao redor do núcleo onde há uma alta probabilidade de encontrar um elétron. Os orbitais são caracterizados por números quânticos que descrevem suas energias, formas e orientações no espaço. Diferentemente das órbitas definidas no modelo de Bohr, os orbitais não implicam trajetórias precisas dos elétrons, mas sim regiões de probabilidade.
Em resumo, a evolução dos modelos atômicos, do modelo de Sommerfeld ao modelo atômico atual baseado na mecânica quântica, reflete um aprofundamento na nossa compreensão da natureza dual dos elétrons, da incerteza inerente à sua posição e momento, e da natureza probabilística da descrição de seu comportamento em torno do núcleo atômico.
