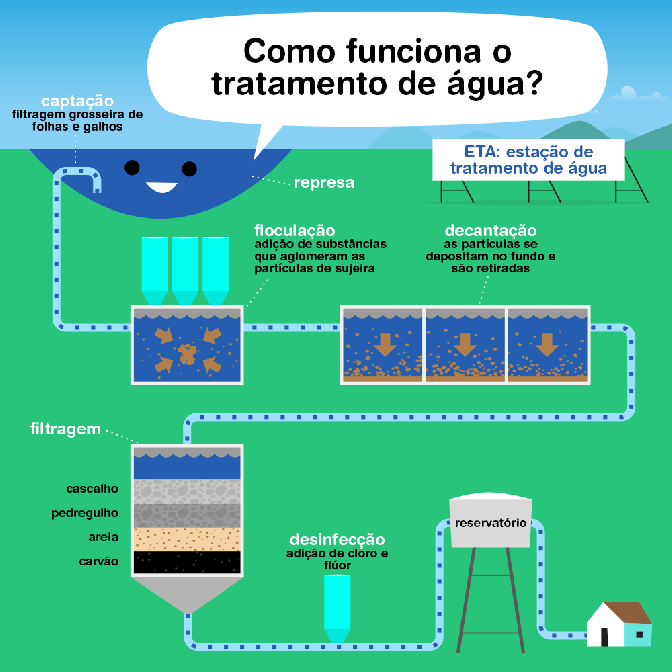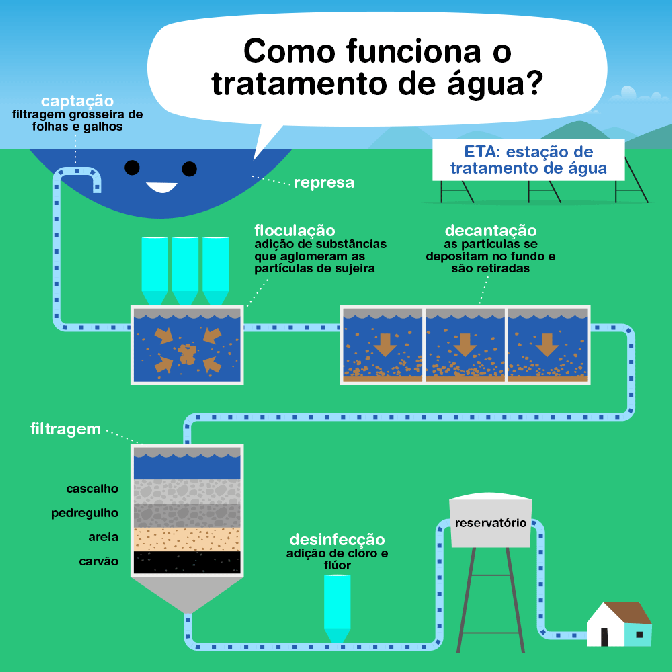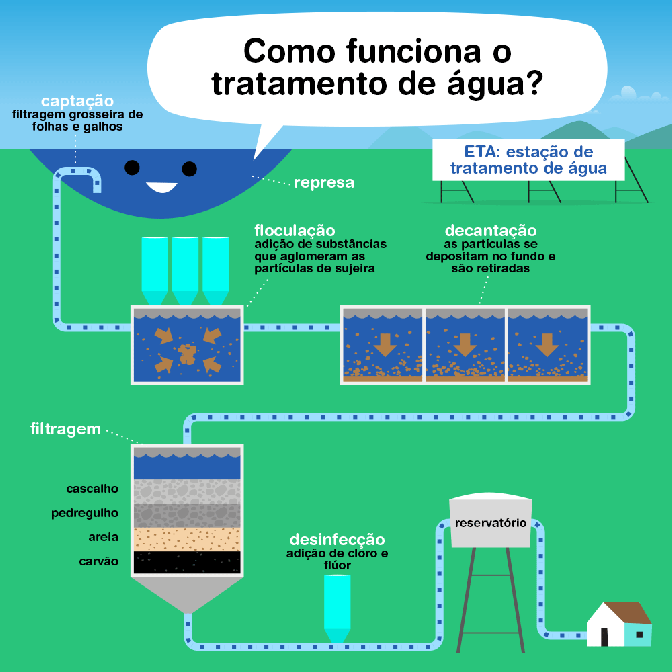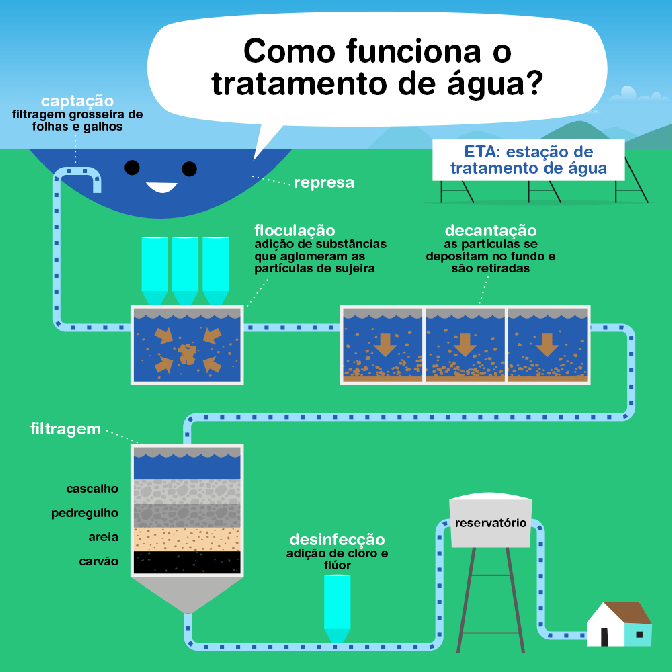
Resumo teórico
Ligação Iônica
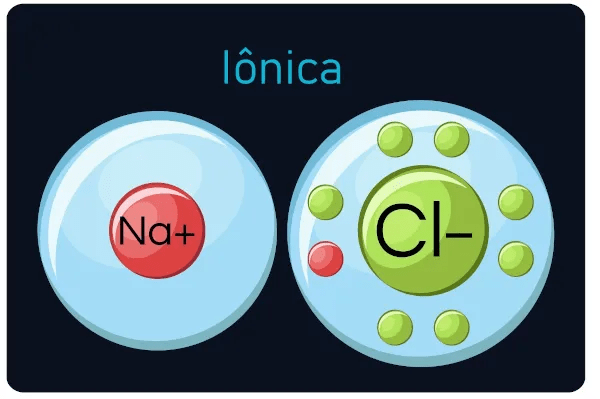
A ligação iônica é um tipo de ligação química que ocorre entre dois átomos com diferenças significativas em suas eletronegatividades, levando à transferência de um ou mais elétrons de um átomo para outro. Esse processo resulta na formação de íons: o átomo que perde elétrons torna-se um cátion (positivamente carregado), enquanto o átomo que ganha elétrons torna-se um ânion (negativamente carregado). A atração eletrostática entre esses íons de cargas opostas mantém a ligação iônica.
Características das Ligações Iônicas
- Formação de Íons: As ligações iônicas envolvem a formação de íons, com um átomo doando elétrons para se tornar um cátion e outro ganhando elétrons para se tornar um ânion.
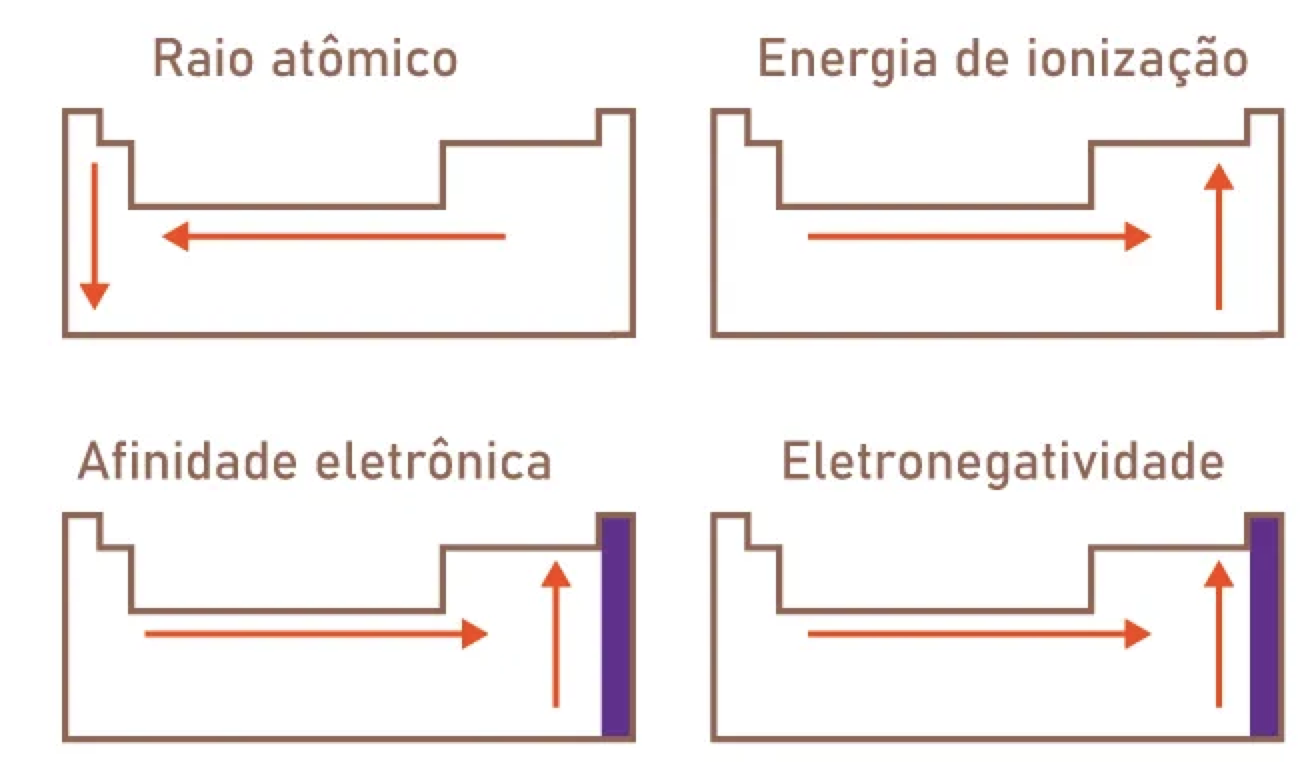
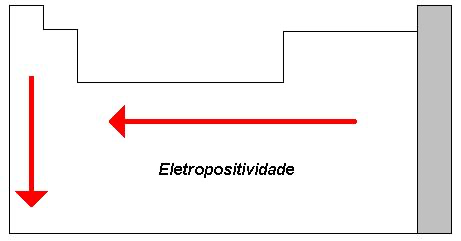
- Diferença de Eletronegatividade: A ligação iônica geralmente ocorre entre metais, que têm baixa eletronegatividade (e, portanto, tendem a perder elétrons), e não-metais, que têm alta eletronegatividade (e tendem a ganhar elétrons).
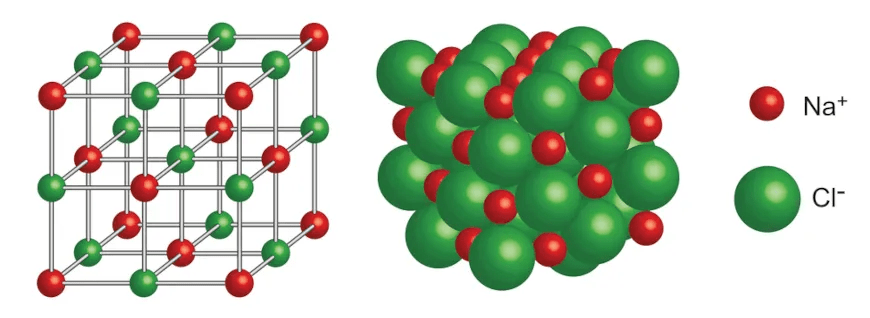
- Estrutura Cristalina: Os compostos iônicos geralmente cristalizam-se em uma estrutura de rede cristalina, organizada de maneira regular para maximizar a atração entre os íons de cargas opostas e minimizar a repulsão entre íons de cargas iguais.
Exemplos de Compostos Iônicos
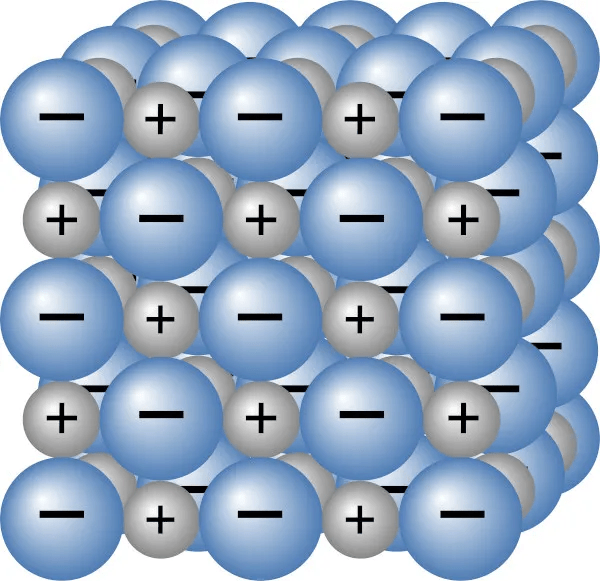
- Cloreto de Sódio (NaCl): Um dos exemplos mais comuns, formado pela transferência de um elétron do sódio (Na) para o cloro (Cl), resultando em íons Na⁺ e Cl⁻.
- Fluoreto de Cálcio (CaF₂): Formado pela transferência de elétrons do cálcio (Ca) para dois átomos de flúor (F), resultando em íons Ca²⁺ e dois íons F⁻.
- Óxido de Magnésio (MgO): Resulta da transferência de dois elétrons do magnésio (Mg) para o oxigênio (O), formando íons Mg²⁺ e O²⁻.
Propriedades dos Compostos Iônicos
- Alto Ponto de Fusão e Ebulição: Devido à forte atração entre os íons, os compostos iônicos têm pontos de fusão e ebulição elevados.
- Solubilidade em Água: Muitos compostos iônicos são solúveis em água, pois a polaridade da água consegue superar as forças iônicas, dissolvendo-os.
- Condução Elétrica: Em estado fundido ou em solução aquosa, os compostos iônicos conduzem eletricidade devido ao movimento livre de íons.
- Dureza e Fragilidade: Os compostos iônicos são geralmente duros devido à forte ligação entre os íons, mas também são frágeis e podem se quebrar sob pressão devido ao alinhamento dos íons de mesma carga que repelem uns aos outros quando uma força é aplicada.
As ligações iônicas são fundamentais para a formação de uma vasta gama de compostos químicos e têm importantes implicações tanto em contextos biológicos quanto em aplicações industriais e tecnológicas.