Atenção Alunos – Meus contatos na rede



No link abaixo você encontra todos os meus contatos, aulas e outros:
Seja bem-vindo(a) ao novo ano letivo! Preparado para uma jornada repleta de experiências e descobertas que nos enriquecerão e nos tornarão mais felizes.




No link abaixo você encontra todos os meus contatos, aulas e outros:
Modelo de Dalton

O modelo atômico de Dalton, formulado no início do século XIX por John Dalton, é um marco na história da química e da física. Baseando-se em experimentos químicos e considerações sobre a natureza da matéria, Dalton propôs quatro postulados principais:
O modelo atômico de Dalton não incluía uma descrição da estrutura interna do átomo, como a existência de elétrons e núcleo, pois esses conceitos ainda não eram conhecidos. Apesar disso, seus postulados estabeleceram a base para o entendimento científico da matéria e abriram caminho para futuras descobertas na química e na física. O modelo de Dalton, embora simplificado e posteriormente modificado por descobertas subsequentes, é reconhecido por sua importância fundamental na transição da alquimia para a química moderna e na evolução do pensamento científico sobre a natureza atômica da matéria.

O modelo atômico de Dalton, formulado no início do século XIX por John Dalton, é um marco na história da química e da física. Baseando-se em experimentos químicos e considerações sobre a natureza da matéria, Dalton propôs quatro postulados principais:
O modelo atômico de Dalton não incluía uma descrição da estrutura interna do átomo, como a existência de elétrons e núcleo, pois esses conceitos ainda não eram conhecidos. Apesar disso, seus postulados estabeleceram a base para o entendimento científico da matéria e abriram caminho para futuras descobertas na química e na física. O modelo de Dalton, embora simplificado e posteriormente modificado por descobertas subsequentes, é reconhecido por sua importância fundamental na transição da alquimia para a química moderna e na evolução do pensamento científico sobre a natureza atômica da matéria.
Leis Ponderais

As leis ponderais são fundamentais na química para entender as reações químicas em termos da massa. Aqui estão elas resumidamente:
Essas leis ajudam a entender e prever os resultados das reações químicas, garantindo a conservação da massa e proporcionando a base para o desenvolvimento de conceitos químicos mais avançados como a estequiometria.


Quero dar as boas-vindas a todos os alunos que estão aqui presentes para o início de mais um ano letivo. É com prazer que iniciamos uma nova etapa de experiências e descobertas que certamente nos farão mais felizes e nos enriquecerão intelectualmente.
Que este seja um ano onde todos alcancem os objetivos propostos e tirem pleno proveito deste maravilhoso processo de aprendizagem!
Coloco o meu site à disposição de todos e desejo um ano de muito sucesso!

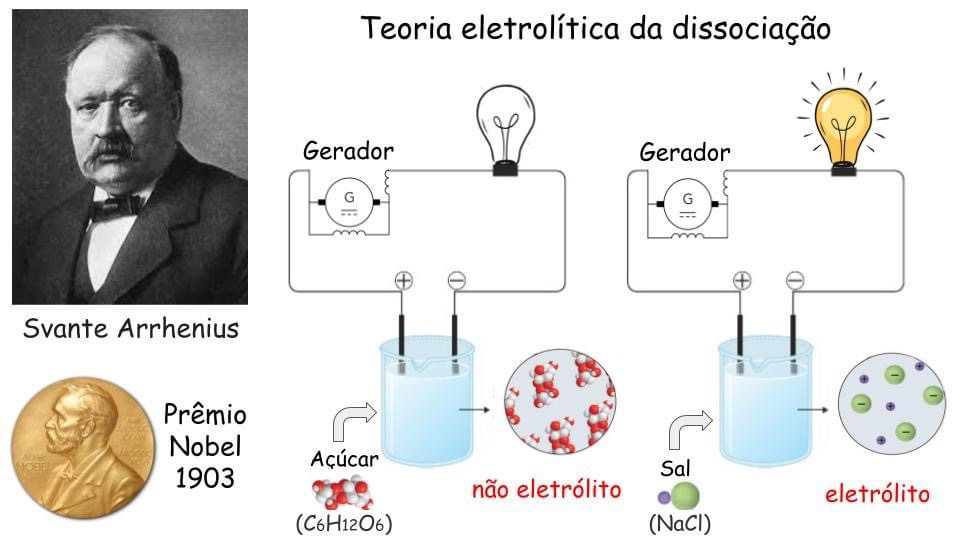
Em 1884, o físico-químico Svante Arrhenius apresentou a sua tese de doutorado sobre a condutividade elétrica de soluções diluídas. É fácil repetirmos alguns de seus experimentos ao dissolvermos açúcar ou sal na água. Podemos constatar que a solução com açúcar não conduz eletricidade, ao passo que a solução salina permite a passagem de corrente elétrica.
O açúcar em contato com a água se divide em porções muito pequenas e com propriedades similares às dos grãos maiores. Arrhenius propôs que quando um sal sólido é dissolvido em água, ele se divide em partículas menores com cargas elétricas. Dessa forma, o sal de cozinha ou cloreto de sódio (NaCl), dissolvido na água, produz Na+ (sódio sem um elétron) e Cl- (cloro com um elétron extra). Esses átomos eletricamente carregados (íons) é que permitem que a solução conduza eletricidade.
Até então imaginava-se que a produção de íons ocorria apenas com a aplicação de energia elétrica, mas Arrhenius sugeriu que os íons podem estar presentes em uma solução. Essa é a Teoria Eletrolítica da Dissociação. Deve-se ressaltar que essa ideia do cientista surgiu 13 anos antes da descoberta do elétron (ver – encurtador.com.br/hsvPV ), a partícula subatômica responsável pela criação de partículas com carga positiva e negativa (chamadas íons). A teoria inovadora levantada por Arrhenius não foi bem recebida e a sua tese foi aprovada com razoável desprezo. Quase duas décadas depois, o Prêmio Nobel de Química de 1903 foi concedido a Arrhenius “em reconhecimento aos serviços extraordinários que prestou ao avanço da química por sua Teoria Eletrolítica da Dissociação”.
REFERÊNCIAS
https://www.nobelprize.org/prizes/chemistry/1903/arrhenius/facts/
