Modelo de Bohr

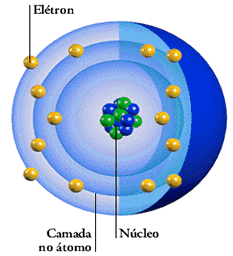
O Modelo Atômico de Bohr, proposto pelo físico dinamarquês Niels Bohr em 1913, representou um avanço significativo na compreensão da estrutura atômica e na mecânica quântica. Este modelo é baseado em três postulados principais:
- Órbitas Estacionárias: Bohr propôs que os elétrons orbitam o núcleo em órbitas específicas, ou níveis de energia, sem irradiar energia. Estas órbitas são chamadas de “órbitas estacionárias”.
- Quantização de Energia: Ele introduziu a ideia de que a energia dos elétrons é quantizada, ou seja, os elétrons só podem ter certos valores de energia específicos. A mudança de um elétron de uma órbita para outra implica na absorção ou emissão de energia em quantidades discretas, chamadas quanta.
- Frequência da Radiação Emitida ou Absorvida: A diferença de energia entre estas órbitas estacionárias é responsável pela emissão ou absorção de radiação eletromagnética, cuja frequência está relacionada com a diferença de energia entre as órbitas.
Características:
- Órbitas Circulares: No modelo de Bohr, os elétrons giram em órbitas circulares ao redor do núcleo.
- Níveis de Energia Quantizados: Cada órbita corresponde a um nível de energia específico.
- Emissão e Absorção de Energia: Quando um elétron transita entre órbitas, ele emite ou absorve um quantum de energia na forma de luz.
Parte Experimental:
O modelo de Bohr foi em grande parte motivado e apoiado pelos resultados experimentais do espectro de emissão do átomo de hidrogênio. Os espectros de linha do hidrogênio, observados experimentalmente, mostravam uma série de linhas que Bohr conseguiu explicar com seu modelo, introduzindo a ideia de que os elétrons saltam entre órbitas fixas.
Importância:
- Ponte para a Mecânica Quântica: O modelo de Bohr foi um passo crucial no desenvolvimento da mecânica quântica. Ele introduziu o conceito de quantização, que se tornou fundamental na teoria quântica posterior.
- Explicação dos Espectros Atômicos: Foi o primeiro modelo que explicou de forma satisfatória os espectros de linhas dos átomos, particularmente o hidrogênio.
- Influência na Física Moderna: Influenciou profundamente a pesquisa subsequente e abriu caminho para modelos mais avançados, como o modelo quântico de átomo.
Apesar de sua importância histórica, o modelo de Bohr foi eventualmente substituído por modelos mais avançados, como o modelo atômico de Schrödinger, que oferece uma descrição mais completa e precisa dos átomos.
